Kelactin
RESUME DES CARACTERISTIQUES DU PRODUIT
1. Dénomination du médicament vétérinaire
KELACTIN 50 µG/ML SOLUTION BUVABLE POUR CHIENS ET CHATS
2. Composition qualitative et quantitative
Un ml contient :
Substance(s) active(s):
Cabergoline : 50 μg
Pour la liste complète des excipients, voir rubrique « Liste des excipients ».
3. Forme pharmaceutique
Solution buvable.
Solution huileuse visqueuse de teinte jaune pâle.
4. Informations cliniques
4.1. Espèces cibles
Chiens et chats.
4.2. Indications d'utilisation, en spécifiant les espèces cibles
Ce produit est indiqué pour les usages suivants :
Traitement de la pseudo-gestation chez la chienne
Tarissement de la sécrétion lactée chez la chienne et la chatte.
4.3. Contre-indications
- Ne pas utiliser chez les animaux gestants car ce produit peut provoquer un avortement.
- Ne pas utiliser en association avec un antagoniste de la dopamine.
- Ne pas utiliser en cas d'hypersensibilité à la substance active ou à l'un des excipients.
La cabergoline est susceptible d'induire une hypotension transitoire chez les animaux traités. Ne pas utiliser chez les animaux traités concomitamment par des médicaments hypotenseurs. Ne pas utiliser immédiatement après une intervention chirurgicale, lorsque l'animal est encore sous l'influence de produits anesthésiques.
4.4. Mises en garde particulières à chaque espèce cible
Un traitement hygiénique complémentaire doit inclure une restriction de la consommation d'eau et de glucides et une augmentation de l'exercice.
4.5. Précautions particulières d'emploi
i) Précautions particulières d'emploi chez l'animal
Sans objet.
ii) Précautions particulières à prendre par la personne qui administre le médicament vétérinaire aux animaux
Se laver les mains après utilisation. Éviter tout contact avec la peau, la bouche ou les yeux. Nettoyer immédiatement les éventuelles éclaboussures.
Les femmes en âge d'avoir des enfants et les femmes qui allaitent ne doivent pas manipuler le produit ou doivent porter des gants jetables lors de l'administration du produit.
Les personnes présentant une hypersensibilité connue à la cabergoline ou à l'un des autres ingrédients du produit devraient éviter tout contact avec le médicament vétérinaire.
Ne pas laisser de seringues pleines sans surveillance en présence d'enfants. En cas d'ingestion accidentelle, en particulier par un enfant, demander immédiatement conseil à un médecin et montrez-lui la notice ou l'étiquetage.
iii) Autres précautions
Aucune.
4.6. Effets indésirables (fréquence et gravité)
Les effets indésirables potentiels sont :
- somnolence
- anorexie
- vomissements
Ces effets indésirables sont généralement d'intensité modérée et transitoires.
Des vomissements ne surviennent généralement qu'après la première administration. En pareil cas, il n'est pas nécessaire d'interrompre le traitement, car les vomissements ne se reproduiront pas après l'administration suivante.
Dans de très rares cas, des réactions allergiques telles qu'œdème, urticaire, dermatite et prurit sont susceptibles de se produire.
Dans de très rares cas, une hypotension transitoire est susceptible de se produire.
Dans de très rares cas, des symptômes neurologiques tels que somnolence, tremblements musculaires, ataxie, hyperactivité et convulsions sont susceptibles de se produire.
La fréquence des effets indésirables est définie en utilisant la convention suivante :
- très fréquent (effets indésirables chez plus d’1 animal sur 10 au cours d’un traitement)
- fréquent (entre 1 et 10 animaux sur 100)
- peu fréquent (entre 1 et 10 animaux sur 1 000)
- rare (entre 1 et 10 animaux sur 10 000)
- très rare (moins d’un animal sur 10 000, y compris les cas isolés).
4.7. Utilisation en cas de gestation, de lactation ou de ponte
- La cabergoline peut provoquer un avortement à un stade avancé de la gestation et ne doit pas être utilisée chez les animaux gestants. Un diagnostic différentiel entre une gestation et une pseudo-gestation doit être correctement établi.
- Le produit est indiqué pour le tarissement de la sécrétion lactée : l'inhibition de la sécrétion de prolactine par la cabergoline induit un arrêt rapide de la lactation et une réduction de la taille des glandes mammaires. Le produit ne doit pas être utilisé chez les animaux qui allaitent, sauf si un tarissement est nécessaire.
4.8. Interactions médicamenteuses et autres formes d'interactions
Comme la cabergoline agit par stimulation directe des récepteurs de la dopamine, le produit ne doit pas être administré en même temps que des médicaments dotés d'une activité antagoniste de la dopamine (par exemple phénothiazines, butyrophénones, métoclopramide), car ces derniers risquent de diminuer ses effets inhibiteurs de la prolactine.
La cabergoline pouvant induire une hypotension transitoire, le produit ne doit pas être administré à des animaux traités simultanément par des médicaments hypotenseurs.
4.9. Posologie et voie d'administration
Le produit doit être administré oralement, soit directement dans la bouche, soit mélangé à la nourriture.
La dose est de 0,1 ml/kg de poids corporel (ce qui équivaut à 5 microgrammes/kg de poids corporel de cabergoline) une fois par jour pendant 4 à 6 jours consécutifs, en fonction de la gravité de l'état clinique.
Si les symptômes ne disparaissent pas après un seul cycle de traitement ou s'ils réapparaissent après la fin du traitement, on peut répéter le cycle de traitement.
Le poids des animaux traités doit être déterminé de manière précise avant l'administration.
Comment prélever le volume recommandé dans le flacon ?
a. Retirer la membrane protectrice de l'emballage de l'adaptateur pour flacon. Ne pas sortir l'adaptateur pour flacon de l'emballage thermoformé.
b. Fixer l'adaptateur au flacon ; utiliser l'emballage thermoformé pour manipuler l'adaptateur. Fixer solidement l'adaptateur sur le flacon en l'enfonçant jusqu'à ce que la pointe perce le bouchon et que l'adaptateur s'enclenche en position.
c. Retirer et éliminer l'emballage thermoformé.
d. Fixer la seringue à l'adaptateur en enfonçant fermement la seringue dans l'adaptateur pour flacon de manière à éviter toute fuite de produit lors du prélèvement de la dose dans le flacon.
e. Prélever le médicament du flacon avec la seringue en maintenant le flacon la tête en bas.
f. Retirer la seringue de l'adaptateur.
g. Le médicament est à présent prêt à être administré.
Il est recommandé de rincer et de sécher la seringue après chaque utilisation.
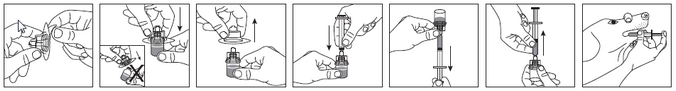
| a. | b. | c. | d. | e. | f. | g. |
4.10. Surdosage (symptômes, conduite d'urgence, antidotes), si nécessaire
Les données expérimentales indiquent qu'un surdosage unique de cabergoline est susceptible d'entraîner un risque accru de vomissements après traitement et éventuellement une augmentation de l'hypotension après traitement.
Mettre en place des mesures générales de soutien en vue d'éliminer le médicament non absorbé et de maintenir la tension artérielle si nécessaire. Comme antidote, on peut envisager l'administration parentérale d'antagonistes de la dopamine tels que la métoclopramide.
4.11. Temps d'attente
Sans objet.
5. Propriétés pharmacologiques
Groupe pharmacothérapeutique : inhibiteur de la prolactine du groupe des dérivés de l'ergoline agissant par le biais d'une activité agoniste de la dopamine.
Code ATC-vet : QG02CB03.
5.1. Propriétés pharmacodynamiques
La pharmacodynamie de la cabergoline a été étudiée dans divers systèmes in vitro et in vivo. Les principales observations peuvent être résumées comme suit :
La cabergoline est un puissant inhibiteur de la sécrétion de prolactine par l'hypophyse et, par conséquent, inhibe les processus qui dépendent de la sécrétion de prolactine tels que la lactation.
Le mécanisme d'action de la cabergoline est une interaction directe avec les récepteurs dopaminergiques D-2 des cellules lactotropes hypophysaires ; cette interaction a un effet persistant.
La cabergoline présente une certaine affinité pour les récepteurs noradrénergiques, mais n'affecte pas le métabolisme de la noradrénaline ou de la sérotonine.
Comme les autres dérivés de l'ergoline, la cabergoline a des effets émétiques (équivalents en puissance à ceux du pergolide et de la bromocriptine).
A fortes doses par voie orale, la cabergoline induit une baisse de la tension artérielle.
5.2. Caractéristiques pharmacocinétiques
Il n'y a pas de données pharmacocinétiques disponibles pour le schéma d'administration recommandé chez le chien et le chat.
Des études pharmacocinétiques ont été réalisées chez le chien à une dose journalière de 80 µg/kg de poids corporel (16 fois la dose recommandée). Les chiens ont été traités pendant 30 jours ; des évaluations pharmacocinétiques ont eu lieu au jour 1 et au jour 28.
Absorption :
Tmax = 1 heure au jour 1 et 0,5 à 2 heures (moyenne : 75 minutes) au jour 28 ;
Cmax variant de 1140 à 3155 pg/ml (moyenne : 2147 pg/ml) au jour 1 et de 455 à 4217 pg/ml (moyenne : 2336 pg/ml) au jour 28 ;
AUC(0-24 h) variant de 3896 à 10216 pg.h.ml-1 (moyenne : 7056 pg.h.ml-1) au jour 1 et de 3231 à 19043 pg.h.ml-1 (moyenne : 11137 pg.h.ml-1) au jour 28.
Élimination :
Demi-vie plasmatique chez le chien : t½ au jour 1 ~ 19 heures ; t½ au jour 28 ~ 10 heures
6. Informations pharmaceutiques
6.1. Liste des excipients
Triglycérides à chaîne moyenne
Azote, faible teneur en oxygène
6.2. Incompatibilités majeures
Ne pas mélanger le produit avec une solution aqueuse (par exemple du lait).
En l'absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.
6.3. Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 2 ans.
Durée de conservation après première ouverture du conditionnement primaire : 14 jours.
6.4. Précautions particulières de conservation
Tel que conditionné pour la vente : à conserver et transporter réfrigéré (entre 2°C et 8°C).
Après première ouverture : à conserver à une température ne dépassant pas 25°C.
Conserver en position verticale.
Conserver le flacon soigneusement fermé dans la boîte en carton afin de le protéger de la lumière.
Ne pas congeler.
6.5. Nature et composition du conditionnement primaire
Flacon verre coloré type III (7 ml et 15 ml)
Flacon verre coloré type II (24 ml)
Bouchon caoutchouc bromobutyle gris
Capsule aluminium
6.6. Précautions particulières à prendre lors de l'élimination de médicaments vétérinaires non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Les conditionnements vides et tout reliquat de produit doivent être éliminés suivant les pratiques en vigueur régies par la réglementation sur les déchets.
7. Titulaire de l'autorisation de mise sur le marché
VEYX-PHARMA
SÖHREWEG 6
34639 SCHWARZENBORN
ALLEMAGNE
8. Numéro(s) d'autorisation de mise sur le marché
FR/V/2255430 9/2012
Boîte contenant 1 flacon de 7 ml, 1 adaptateur et 1 seringue graduée de 1 ml
Boîte contenant 1 flacon de 15 ml, 1 adaptateur et 1 seringue graduée de 3 ml
Boîte contenant 1 flacon de 24 ml, 1 adaptateur et 1 seringue graduée de 3 ml
Toutes les présentations peuvent ne pas être commercialisées.
9. Date de première autorisation/renouvellement de l'autorisation
09/02/2012 - 16/02/2017
10. Date de mise à jour du texte
11/09/2020





 : contact@destaing.com
: contact@destaing.com : +33 (0)4 93 42 02 00
: +33 (0)4 93 42 02 00 : +33 (0)4 93 42 03 00
: +33 (0)4 93 42 03 00